さらに重要なのが、脳を支える血管の存在です。
血管は酸素や栄養を運ぶだけでなく、脳の発生や機能に関するシグナル(合図)を出すなど、ただの“管”以上の役割を果たしています。
しかし、これまでのオルガノイド研究では十分に血管の構造や機能を再現するのが難しく、オルガノイドを大きく育てると中心部分が死んでしまうなどの問題がありました。
こうした背景から、複数の脳領域をまとめて再現し、しかも血管に近い細胞が加わったモデルをつくろうとする取り組みが近年活発化しています。
なかでも、大脳だけでなく後脳や中脳、そして血管のもととなる上皮細胞などをひとつに融合するアプローチは、いっそうヒト胎児脳に近い“ミニ脳”を育てるカギと期待されています。
これが今回の研究で紹介された“多領域脳オルガノイド”という新しいモデルです。
こうしたよりリアルなオルガノイドが実現すれば、脳科学の謎に迫るだけでなく、自閉症や統合失調症といった複雑な神経発達障害の仕組み解明にも大きく貢献できると期待されています。
衝撃の成果:融合脳オルガノイドが“胎児脳”に近づく
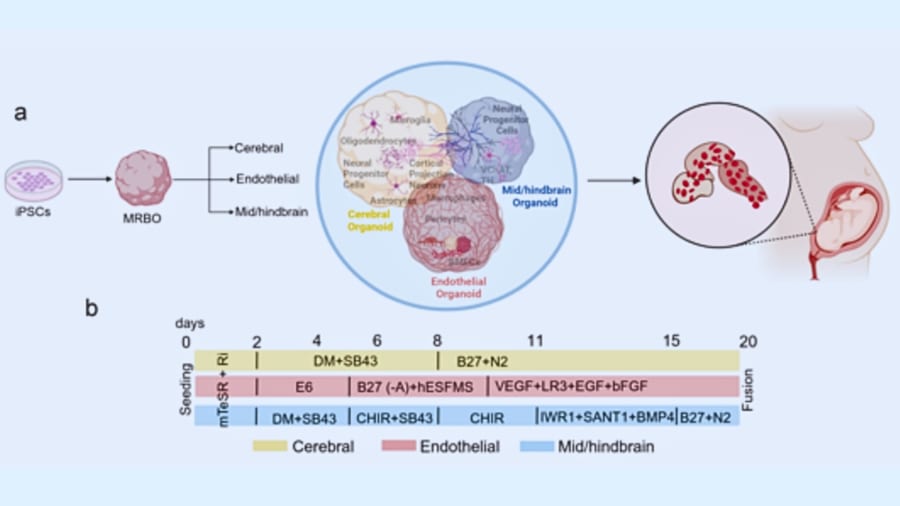 培養皿で育つ人間の融合脳が胎児の段階に到達 / これは研究チームがどのようにして複数の脳領域オルガノイドを生成し、これらを統合して多系統脳オルガノイド(MRBO)を作製したか、そのプロセスと分子レベルでの特徴付けを包括的に示す重要な図です。(a) は基本原理とプロセスの模式図です。(a) では、iPS細胞(誘導多能性幹細胞)を出発点として、どのように大脳、血管内皮(エンドセリウム)、そして中・後脳オルガノイドが個別に生成され、最終的に融合されるかが示されています。各オルガノイドは、特定の分化経路を誘導するためのシグナル分子(例えば、ダブルSMAD阻害やFGF、レチノイン酸など)を用いて作られ、後に適切な条件下で融合されることで、ひとつの統合体としてのMRBOが形成されます。ここでは、オルガノイド同士の融合によって各領域の細胞が相互作用し、実際の胎児脳に近い多様な細胞集団が再現されるという狙いが込められています。(b) はプロトコルのタイムラインです。各オルガノイド(大脳、血管内皮、中・後脳)の生成から融合までのスケジュールを時系列で示しています。たとえば、大脳オルガノイドは初期段階でダブルSMAD阻害による神経誘導が行われ、血管内皮オルガノイドはレチノイン酸とbFGFを含む培地で分化が促進されるといった、各オルガノイドの培養条件や時間軸が明確に描かれています。これにより、研究者は各領域がいつ、どのタイミングで融合プロセスに入るのかを正確に把握できます。/Credit:Anannya Kshirsagar et al . bioRxiv (2025)
培養皿で育つ人間の融合脳が胎児の段階に到達 / これは研究チームがどのようにして複数の脳領域オルガノイドを生成し、これらを統合して多系統脳オルガノイド(MRBO)を作製したか、そのプロセスと分子レベルでの特徴付けを包括的に示す重要な図です。(a) は基本原理とプロセスの模式図です。(a) では、iPS細胞(誘導多能性幹細胞)を出発点として、どのように大脳、血管内皮(エンドセリウム)、そして中・後脳オルガノイドが個別に生成され、最終的に融合されるかが示されています。各オルガノイドは、特定の分化経路を誘導するためのシグナル分子(例えば、ダブルSMAD阻害やFGF、レチノイン酸など)を用いて作られ、後に適切な条件下で融合されることで、ひとつの統合体としてのMRBOが形成されます。ここでは、オルガノイド同士の融合によって各領域の細胞が相互作用し、実際の胎児脳に近い多様な細胞集団が再現されるという狙いが込められています。(b) はプロトコルのタイムラインです。各オルガノイド(大脳、血管内皮、中・後脳)の生成から融合までのスケジュールを時系列で示しています。たとえば、大脳オルガノイドは初期段階でダブルSMAD阻害による神経誘導が行われ、血管内皮オルガノイドはレチノイン酸とbFGFを含む培地で分化が促進されるといった、各オルガノイドの培養条件や時間軸が明確に描かれています。これにより、研究者は各領域がいつ、どのタイミングで融合プロセスに入るのかを正確に把握できます。/Credit:Anannya Kshirsagar et al . bioRxiv (2025)















































