20世紀のはじめ、第一次大戦が終りを迎えた頃、物理学は光の「波動説」と「粒子説」の2つの間で揺れていました。
光が矛盾するどちらの性質でも成立してしまったために、皆が困惑していたのです。
1922年、アーサー・コンプトンがコンプトン効果を発見したことで、光の粒子性は決定的なものになっていました。
コンプトン効果とは、電子にX線をぶつけたとき、弾かれて散乱したX線の波長が伸びるという現象のことです。
波長が伸びるということは、X線が電子にぶつかってエネルギー(運動量)を失ったことを意味しています。
しかし波は運動量を持ちません。
この現象を説明するためには、X線が実は粒子であり、ビリヤードの玉のように電子にぶつかって運動量を奪われたと解釈するしかないのです。
こうして、この時代の物理学者たちは、月曜と水曜と金曜は光の波動論を教え、火曜と木曜と土曜は光の粒子論を教えなければならない、と冗談交じりに愚痴るような状況になりました。
それは目で見て頭でイメージできる馴染み深い古典物理学の世界が、崩壊したことを意味していましたが、まだこのとき多くの物理学者たちはその事実を受け入れることができなかったのです。
物質の全ては波
物理学の常識では同時に成り立つはずのない2つの性質「粒子」と「波動」が、どちらも成り立ってしまうという問題に対し、最初の光を当てたのが、物理学者としては異例の系譜を持つフランス公爵家出身の貴公子ルイ・ド・ブロイでした。

彼はX線を研究する兄モーリスの影響で物理学にはまっていき、兄が公爵家を継ぐために科学の道を諦めたため、その意志を引き継いで物理学者になりました。
ド・ブロイの発想は非常に画期的でした。
彼は光が粒子なのか、波なのかという論争を物理学者たちが繰り広げる中で、次のようなことを考えたのです。
「波であるはずの光が粒子のように振る舞うのだとしたら、原子などの粒子は波のように振る舞うのではないだろうか?」
ド・ブロイはこの考えに基づき、当時太陽の周りを回る惑星のように原子核の周りを軌道を描いて回る粒子だ、と考えられていた原子内の電子を定在波であると仮定した論文を書いたのです。
一見突拍子もないド・ブロイの思いつきですが、この理論はボーアの原子モデルが抱えていた問題を見事に説明することができました。
ボーアが新しい原子モデルを発表した当初、多くの物理学者は次のような疑問を唱えていました。
「電子が加速して運動した場合、電磁エネルギーが放射され電子は自身のエネルギーを失ってしまうはずだ。そうなると電子は原子核に落下してしまうだろう」
そこで、ボーアは「特別(定常的)な軌道を回るときは、電子はエネルギー放射を行わないので、原子核に落ちることはない」と説明しました。
ボーアは数学的にその軌道の長さや、エネルギー量を計算して示すことにも成功しましたが、「ではなぜ特別な軌道上では電子がエネルギー放射をしないのか?」という疑問には答えられなかったのです。
もしド・ブロイの主張する通り、電子が粒子でなく波なのだとしたら、それは運動しているわけではありません。
粒子の運動でないなら、電子は加速することもなくエネルギー放射を行うこともありません。つまり原子核に落下することもなくなるのです。
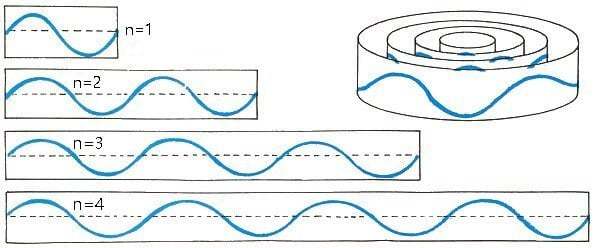
しかも、ド・ブロイの考える定在波の電子は、原子核の周りでぐるりと円を描いて繋がっているため、波形のずれる長さでは成立しません。
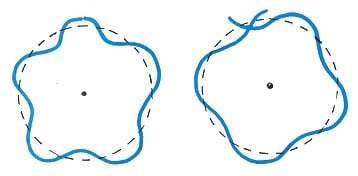
軌道の長さは、必ず電子の波長の整数倍でなければならず、それはボーアが計算した電子の軌道とピタリと一致しました。
つまり「電子に定常的な軌道が存在する理由」についても、ド・ブロイの理論は説明することができたのです。
しかし、このアイデアがすぐに物理学者たちに受け入れられることはありませんでした。
なにせ、この論文はド・ブロイが学位取得のために書いた博士論文だったのです。
けれど、この論文を手放しで評価した人物が現れました。
それが、光電効果によるノーベル賞受賞と、一般相対性理論の発表をほぼ同時期に果たし、一躍時の人となっていたアインシュタインでした。
当時の物理学会にとってアインシュタインの太鼓判は、ド・ブロイの考えを受け入れるのに十分な理由でした。
しかし、「粒子だと思っていた電子が波である」などという主張はどうやって証明すればいいのでしょう?
ド・ブロイはそれについて、「電子が波の性質を持つならば、電子も回析を起こすはずだ」という予想を述べました。
このド・ブロイの予想は、後に複数の物理学者たちの実験によって証明されます。
その中の一人が、ジョージ・トムソンでした。この功績によりジョージ・トムソンはノーベル物理学賞を受賞します。
ちなみに、彼の父、J・J・トムソンは電子が粒子であることを発見し、ノーベル物理学賞を受賞した科学者です。
トムソン親子は驚いたことに、それぞれ「電子は粒子である」「電子は波である」ということを実験で証明し、親子二代でノーベル賞を受賞してしまったのです。
これには物理学者たちも苦笑いだったでしょう。
もはや、光も電子も「波でありながら粒子の性質を示す」ことは間違いのない事実となりました。
ただ問題は、波と粒子が同時に成り立つことを、古典物理学の概念では表現できないことです。
ここからの物理学に求められるのは、見慣れた世界を捨て去った新しい理論だったのです。
パウリの排他原理
古典物理学では光も電子も手に負えないということが徐々に明らかになり、物理の世界は新しい理論を求めるようになっていました。
こうした中登場したのが、量子力学の歴史を語る上で欠かすことのできない重要人物の一人、ヴォルフガング・パウリです。
彼はかなり早熟の天才でした。
世の中には「授業中に机の下に隠した漫画を読んでいた」なんて不届きな人もいるかも知れませんが、パウリの場合、退屈な授業中に隠れて読んでいたのは、アインシュタインの相対性理論の論文でした。

彼の最初の師となったのは、前回登場した「ボーアの原子モデル」に電子軌道が楕円という修正を加えて完成形に近づけたゾンマーフェルトでした。
ゾンマーフェルトは数理科学百科事典という物理をまとめた本を作っていて、相対性理論の解説をアインシュタインに依頼しましたが断られたため、まだ19歳だったパウリにその編集を任せました。
ゾンマーフェルトとしては、パウリに大雑把な草稿を作ってもらい自分で修正して本稿に仕上げるというつもりだったのでしょう。
ところがパウリの書いた相対性理論の解説は完璧なもので、ゾンマーフェルトが「自分が直すところは何もない」と驚くほどの出来栄えだったのです。
それは後日アインシュタイン本人も読むことになり、その深い洞察に称賛を送ったといいます。
そんなパウリでしたが、根っからの理論物理学者で、実験は大の苦手でした。実験器具もよく壊していたため、そのうち近づくだけで器具が壊れると噂されるようになり、科学と無縁のこの現象は仲間たちから冗談めかして「パウリ効果」と呼ばれました。
パウリはその後いくつかの研究室を渡り歩き、ボーアの講演に感銘を受けて、コペンハーゲンの研究所へ行くことになります。
この研究所滞在は1年という期限付きのものでしたが、パウリとボーアの付き合いはこの後生涯に渡って続きます。
このとき、ボーアは電子殻モデルというものを発表しています。
化学の教科書を開くと必ず載っている元素周期表というものがありますが、この表の縦列に並ぶ元素は基本的に化学的な性質がよく似ています。
特に一番右側の列に並ぶ希ガス元素(下図で黄色の列)は、極めて安定性が高くほとんど化学反応を起こしません。
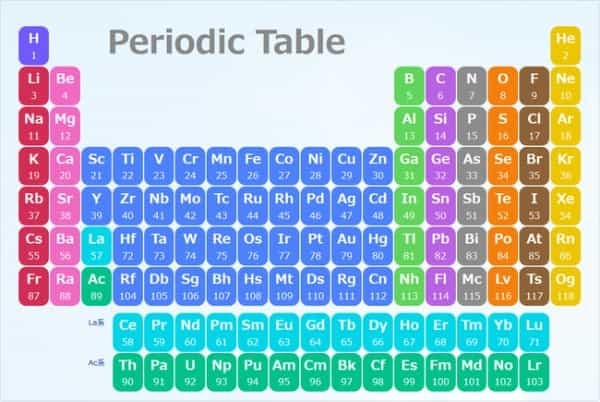
しかしこの元素周期表は、当時の実験結果から経験的に発見されたもので、なぜ元素がこうした並びで周期的に似た性質を表すのか、その理由はよくわかっていませんでした。
これを説明したのがボーアの電子殻モデルです。
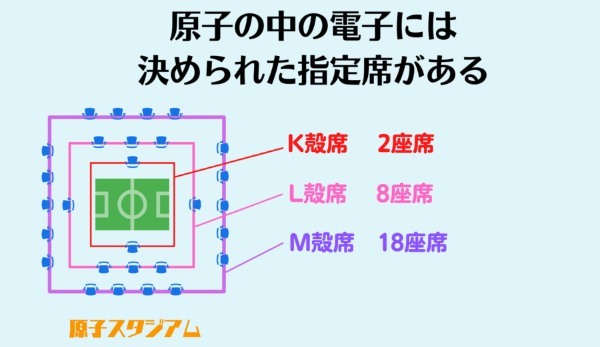
ボーアは、原子の中の電子にはまるでスタジアムのアリーナ席やスタンド席のように、座席数の決められた殻があると仮定しました。
そしてその決められた座席がすべて埋まると電子殻が閉じて化学的に極めて安定した状態になると考えたのです。
また元素周期表の並びから、この殻は内側からK殻、L殻、M殻などの種類があって、それぞれに入れる電子の数は2個、8個、18個になるということも明らかにしました。
化学的な性質は、この最外殻にある電子の数によって決まっているのです。
ボーアの電子殻モデルは、どうして周期的に元素に似た性質が現れるのかという、元素周期表の並びの意味を見事に説明しました。
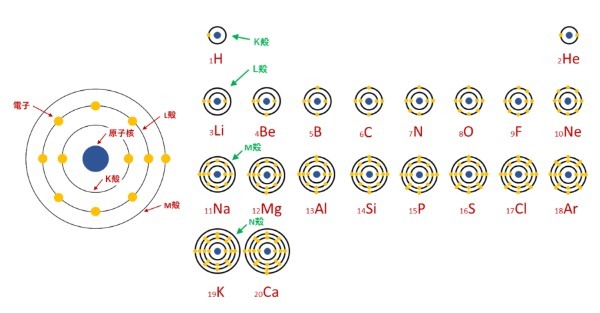
けれどボーアは相変わらずインスピレーションに頼ってこの理論を導いていて、なぜ電子の指定席のようなものが原子の中にあるのか説明することはできなかったのです。
恩師のラザフォードも優れたアイデアであることは認めつつも、「なぜ君がこの結論に至ったのかがまるで理解できない」と困惑したといいます。
しかし、ボーアはこのモデルをもとに当時未発見だった、元素番号72番の性質について予想を述べ、それは後に発見されたハフニウムと一致します。
このためボーアの電子殻モデルは無視できない重要理論であると考えられるようになりました。
では、ボーアの主張した電子の座席数の正体とは一体なんなのでしょうか?
この疑問に答えるためのヒントは、ラザフォードの研究室にいた大学院生エドマンド・ストーナーが発見します。
ボーア・ゾンマーフェルトの原子モデルでは、電子のエネルギー準位を決定するために、軌道の大きさ(n)、軌道の形(k)、軌道の向き(m)という3つのパラメータ(量子数)を使っていました。
ストーナーはこの3つの量子数を使って計算すると、それぞれの電子殻で電子が取ることのできるエネルギー状態が、1個、4個、9個に決定できるということを発見するのです。
つまりストーナーは、上で示した電子の座席数がこのエネルギー状態の2倍の数であることを示したのです。
パウリはこの研究をヒントにして、現代まで彼の名を轟かせる「パウリの排他原理」を思いつきます。
電子は軌道上で、あるエネルギー状態を作りますが互いに同じエネルギー状態に入ることができません。
それが電子殻に入れる電子数に上限を生み出していて、座席数の決まったスタジアムのような状態にしていたのです。
しかし電子殻の上限は、なぜ電子の取りうるエネルギー状態数の2倍になるのでしょうか?
パウリはこの原因が、実は電子のエネルギー状態を決定するパラメータを1つ見落としているためではないかと考えます。
彼はこのとき、磁場の影響で線スペクトルが分裂する「異常ゼーマン効果」の原因解明に苦しんでいましたが、この問題を解決する鍵が「磁場に影響される新しいパラメータ(電子の自由度)ではないか?」 と気づくのです。
そして、パウリはそのパラメータに二価性という名を付けて導入します。
これは簡単にいうなら、電子のエネルギー状態をさらに2種類の状態に分割するものでした。
あるエネルギー状態Xがあったとすると、そこにXAとXBという状態を追加するわけです。
これにより、ボーアの主張した各電子殻に入る電子の上限と、ストーナーの計算した電子殻の電子が取るエネルギー状態の数が一致し、電子殻に関する基礎理論が完成したのです。
ただ、この二価性というパラメータが実際には電子の何を表現しているのかは、パウリ自身もわかっていませんでした。













































