かつて生物学のワイズマンは、マウスの尻尾を20世代に渡って切り続ける実験を行いました。
彼の手によって尻尾を切られたマウスは1500匹に及ぶとされています。
実験の目的は、親が体験した怪我や病気・記憶が子供に遺伝するかを確認するためでした。
遺伝学が未発達だった時代では、親の体験が子供に遺伝すると考えられていたからです。
人間で例えるならば、頭がいい親から頭がいい子供がうまれてくるのは、親が努力してたくさん勉強したからだ、と考えられていたのです。
しかしワイズマンがいくら親の尻尾を切っても生まれてきた子マウスの尻尾は短くなりませんでした。
今から考えれば当然の結果と言えるでしょうが、当時では画期的な発見だったのです。
そしてワイズマンたち生物学者の研究をもとに古い生物学の教科書には「親が後天的に(大人になってから)体験した病気や怪我・記憶は子孫に遺伝しないと」書かれるようになりました。
しかし中国の浙江大学(ZJU)で行われた研究では、糖尿病の体験が母親の卵子を通して子供に遺伝していることが示されました。
つまり獲得形質としての糖尿病が遺伝していたのです。
しかし、いったいどんな仕組みで後天的な病気が子孫に遺伝するのでしょうか?
研究内容の詳細は2022年5月18日に『Nature』に掲載されました。
目次
糖尿病になったメスの卵子は糖尿病になりやすい子を作る
原因は遺伝子の封印解除機構に起きた異常だった
糖尿病になったメスの卵子は糖尿病になりやすい子を作る

研究はよく知られている事実を発端にしています。
妊娠前や妊娠中に食べる量が多すぎたり少なすぎる場合、うまれてくる子供の体重が成人後に過剰になり、生活習慣に起因する2型糖尿病にかかりやすくなることが知られています。
母親が適正な量を「ちゃんと食べる」ことは、新生児の成長だけでなく成人後の健康にも影響を与えているのです。
何気ない事実に思えますが、妊娠前および妊娠中の食事が子供の20年後・30年後・50年後の健康にも影響するという事実は、遺伝子レベルでの深い影響がある可能性を示しています。
同様の結果はマウスを用いた実験でも判明しています。
妊娠の前後に過剰あるいは過小な食事をとらされたマウスからうまれた子供は、成長後も体重が安定せず、糖尿病などにかかりやすくなっていました。
つまり人間やマウスにおいても、親の体験が子供に遺伝している可能性があったのです。
しかし、どのような仕組みが私たち哺乳類において体験の遺伝を引き起こしているかは不明でした。
そこで今回、浙江大学の研究者たちはマウスを使って、後天的な糖尿病が遺伝するかを調べることにしました。
実験にあたってはまず妊娠前のメスマウスに対して、膵臓のインスリン生産細胞だけを破壊する毒素を注入することからはじめられました。
インスリン生産細胞が破壊されたメスマウスは慢性的な高血糖を起こし、糖尿病になってしまいます。
次に研究者たちはこの強制的に糖尿病にされたメスマウスから卵子を取り出し、健康なオスマウスの精子を体外受精させて、代理母の子宮に移植しました。
この操作によって、うまれてくる子マウスへの影響を、卵子を取り出したメスマウスの糖尿病だけに限定することが可能になります。

研究者たちは子マウスの成長を見守りつつ、経時的な変化を観察しました。
すると糖尿病になったメスマウスの卵子から作られた子マウスでは、対象群の子マウスに比べて糖代謝を上手く行えないことが判明します。
また異常はメスの子マウスよりもオスの子マウスでより顕著であり、高脂肪食品をとらせた場合にはさらに悪化することが判明します。
また糖代謝の異常は主に、膵臓のベータ細胞によるインスリン分泌量の低下であることも明らかになりました。
この結果は、膵臓のインスリン生産機能を後天的に破壊されるという「体験」をしたメスマウスの卵子からは、インスリンの分泌量が低下した子マウスがうまれてきたことを示します。
つまり親の体験が子供に遺伝していたのです。
問題は、背後にどんなメカニズムが存在するかです。
原因は遺伝子の封印解除機構に起きた異常だった

体験の遺伝はどんな仕組みで起きていたのか?
謎を確かめるため研究者たちは、子マウスの遺伝子活性の大規模な解析を行いました。
すると糖尿病のメスマウスの卵子から作られた子マウスでは対象群の子マウスと比べて何百もの遺伝子の活性が異なっていることが判明します。
特に「Tet3」と呼ばれる遺伝子では、卵子内部での遺伝子活性(転写量)が対象群の半分にまで落ちていました。
「Tet3」は遺伝子の封印(メチル化)を解除(脱メチル化)するために重要な働きを持っています。
生物の遺伝子機能はDNAの塩基配列によって支配されるだけでなく、どの遺伝子をONあるいはOFFにするかを決めるDNAにほどこされた封印タグ(メチル化)によっても支配されています。
封印タグ(メチル化)が付けられた遺伝子は活性が抑えられ、ときには欠損しているかのような働きをすることがあります。
このような遺伝子変化は「エピジェネティック」な変化と呼ばれています。
エピジェネティックな変化が卵子や精子で起きると、封印タグの位置が受精卵にも引き継がれ、子孫の体を作る細胞全てに封印タグの位置が適応されることになります。
ただこのままでは世代を重ねるごとにDNAが封印タグだらけになってしまい、あらゆる遺伝子が働かなくなってしまいます。
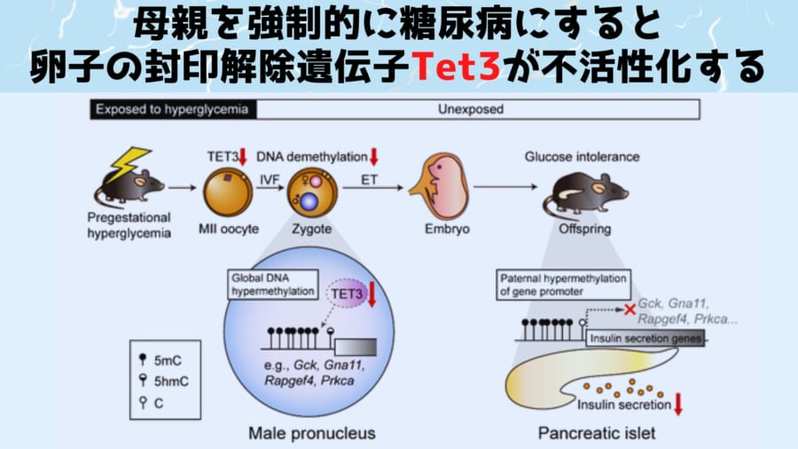
そのため卵子には封印タグを解除(脱メチル化)する「Tet3」のような遺伝子が働いており、親の体験が遺伝されるのをある程度、防いでいます。
しかし研究者たちが分析を行ったところ、糖尿病になったメスマウスの卵子では封印タグを解除するための遺伝子「Tet3」の活性を促進する部位(プロモーター)にまで封印タグがつけられており、遺伝子活性が大幅に低下していたことが判明します。
封印解除遺伝子の働きが鈍った受精卵では各遺伝子に付された封印タグの解除が困難になったと推測されます。
実際、研究者たちが遺伝子活性を調べたところ、「Tet3」の働きが鈍ると、特に父親由来のDNAにおいて、インスリン分泌に重要なグルコキナーゼの遺伝子の封印が強く行われていることが判明します。
(※精子のDNAは卵子のDNAに比べてメチル化率が高くなっています)
グルコキナーゼの働きが鈍ればインスリンが減り、糖尿病になりやすくなってしまいます。
まとめると、糖尿病のメスマウスの卵子では封印解除遺伝子「Tet3」の働きが封印されており、受精卵をへて成長した子マウスの膵臓ではインスリン分泌に重要なグルコキナーゼの遺伝子が封印されたままのため、結果として糖尿病になりやすくなっていたのです。
ですがより興味深い結果が、人間の初期胚をすり潰した結果から得られました。













































