mRNAがんワクチンは全てが「特注性」
新たな方法では、mRNAワクチンの進化したバージョンが使われます。
がん細胞では変異したDNAをもとに変異したRNAが生産され、最終的にネオアンチゲンと呼ばれる異常なタンパク質を生産します。
たとえば細胞全体を巨大なビルだとすると、DNAは全体の設計情報の記載は何十個もの大きなスパコンと言えるでしょう。
○○階の✕✕部屋の情報が欲しいというときに、大きなスパコンをいちいち現場に引っ張っていくのは現実的ではありません。
そのため細胞には、必要な部分の情報だけを写した部分写しとしてRNAを生産します。
最後に部分写しであるRNAは「現場」に運ばれ、部品となるタンパク質を生産します。
そして生産されるタンパク質の量は、部分写しであるRNAが多ければ多いほどたくさん作られる傾向があります。
がん細胞の場合、DNAそのものに変異があるため、生産されるタンパク質も異常となり、違法建築のように細胞表面にも異常な構造が現れます。
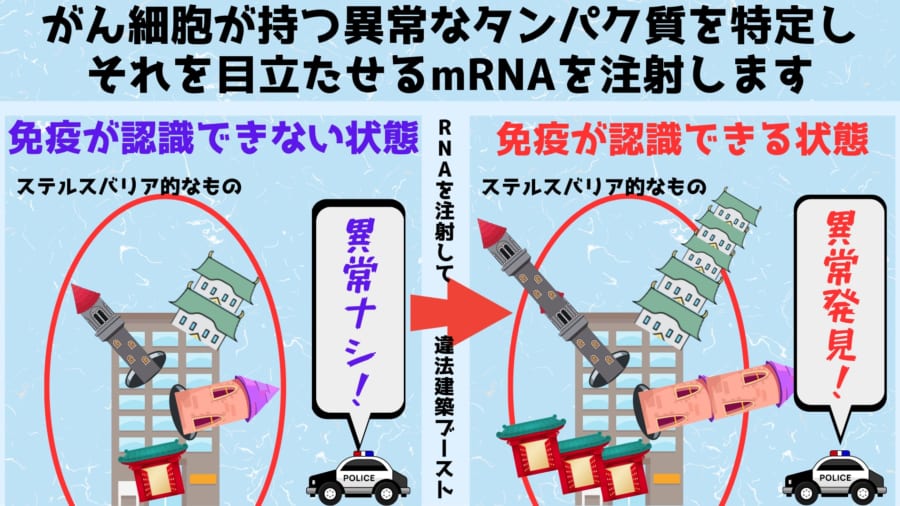
モデルナのがんワクチンでは、この仕組みを利用して、がん細胞の目印となるネオアンチゲン(異常なタンパク質)の設計情報を含んだmRNAを患者の体内に注射します。
このネオアンチゲンの設計情報は患者1人1人の変異DNAに対応した「個別化されたmRNA」となっており、最大限の効果を発揮するように作られています。
(※mRNAがんワクチンは患者個人にあわせた特注品であるため、他人に処方されたワクチンを接種しても効果が得られなくなっています)
すると患者の細胞ではmRNAの指示に従って、がん細胞だけが持つネオアンチゲンが大量に生産され、免疫システムに異物として認識されやすくなります。
さらにメルクが開発した免疫療法を併用して免疫細胞の認識能力を強化することで、免疫システムはネオアンチゲンを生産するがん細胞を完全に「ロックオン」することが可能になります。
(※新たなmRNAがんワクチンでは34種類のネオアンチゲンを生成するように機能します)
実際の試験ではステージ3および4の154人の黒色腫患者が集められ、mRNAがんワクチンと免疫療法の併用が行われました。
モデルナのmRNAがんワクチンは9回投与され、メルクの免疫療法薬「キイトルーダ」は3週間ごとに18回投与(最大で1年間投与)されました。
新型コロナウイルスのワクチンが2回でよかったのに比べて9回と多いのは、相手がウイルスとがん細胞の違いにあるからだと言えるでしょう。
(※ウイルスは完全な外敵ですが、がん細胞はもともとは自分の体の細胞であるため、免疫の訓練期間が長く必要なのです)
結果、免疫療法薬「キイトルーダ―」を単体で治療したのに比べて、3年間で再発と死亡リスクを44%減少させることに成功しました。
一方で、重篤な副作用は患者の14.4%で発生したことが確認され、しばしば使用の一時中断や永久中止の判断がなされました。
生命にかかわる重篤な副作用としては、免疫介在性大腸炎、免疫介在性肝炎、副腎不全、下垂体炎、甲状腺疾患などがあげら、患者の1人は免疫介在性大腸炎により死亡しました。
がんワクチンは未来の治療法になり得る
この成果は、mRNAワクチンがウイルス感染の予防薬としてだけではなく、がんの治療薬として機能することを示しています。
現在mRNAワクチンとして承認されているのは新型コロナウイルスのワクチンだけですが、将来的にはさまざまな病気に対する「治療用ワクチン」が開発されるでしょう。
モデルナとメルクは去年の7月から第3相試験を開始するだけでなく、モデルナは既にmRNAがんワクチンの製造施設をマサチューセッツ州に建設し始めています。
(※mRNAがんワクチンはFDAより画期的治療薬の称号を受けており、承認の迅速化が図られることになりました)
モデルナのCEOであるステファン・バンセル氏は、早ければ2025年には、ワクチンの承認を得られる可能性があると述べています。
全ての画像を見る
参考文献
Moderna and Merck Announce mRNA-4157/V940, an Investigational Personalized mRNA Cancer Vaccine, in Combination with KEYTRUDA(R) (pembrolizumab), Met Primary Efficacy Endpoint in Phase 2b KEYNOTE-942 Trial
ライター
川勝康弘: ナゾロジー副編集長。 大学で研究生活を送ること10年と少し。 小説家としての活動履歴あり。 専門は生物学ですが、量子力学・社会学・医学・薬学なども担当します。 日々の記事作成は可能な限り、一次資料たる論文を元にするよう心がけています。 夢は最新科学をまとめて小学生用に本にすること。
編集者
海沼 賢: 以前はKAIN名義で記事投稿をしていましたが、現在はナゾロジーのディレクションを担当。大学では電気電子工学、大学院では知識科学を専攻。科学進歩と共に分断されがちな分野間交流の場、一般の人々が科学知識とふれあう場の創出を目指しています。






































