寄生虫が脳細胞に薬を運び込む仕組み
これまでの研究により、トキソプラズマには複数の異なるタンパク質分泌システムがあることが知られています。
そのうちのいくつかはロプトリーと高密度顆粒と呼ばれる細胞内小器官によって機能します。
細胞内小器官と言えばミトコンドリアや葉緑体を想像する人が多いかもしれませんが、これらの細胞内小器官はトキソプラズマの寄生生活を助ける役割を担っています。
たとえば、ロプトリーは寄生先の細胞にタンパク質を注入し、トキソプラズマがニューロンに侵入するのを助けます。
また、高密度顆粒はトキソプラズマがニューロン内部に侵入した後、ニューロン内部でトキソプラズマ由来のタンパク質を分泌し、細胞内で安定して定着するのを助けます。
どちらも、感染される人間にとっては厄介な性質ですが、注目すべきは、このどちらもが細胞内部にタンパク質を送り込む役割を担っている点です。

つまり、トキソプラズマはニューロンの外側からも内側からもタンパク質を分泌できるのです。
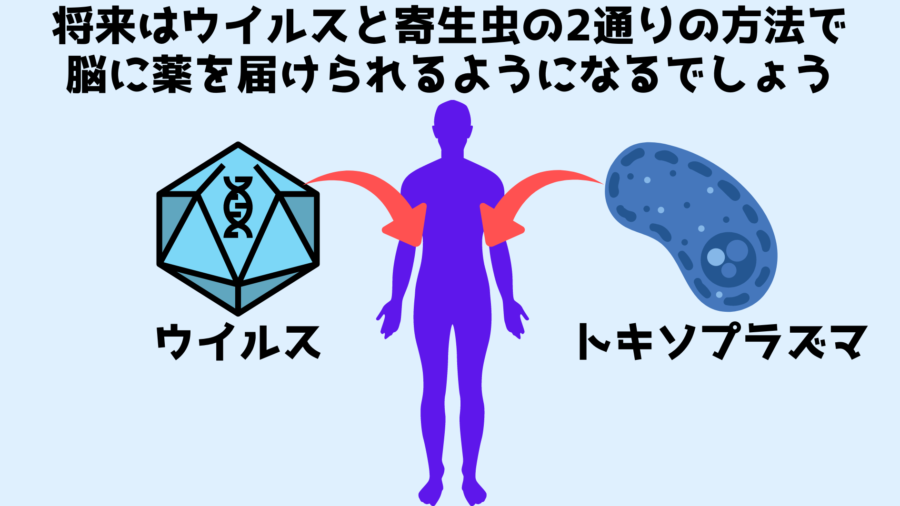
そのため、もしトキソプラズマの遺伝子を書き換えて、トキソプラズマがもともと分泌するタンパク質を薬としての効果のあるタンパク質に変えることができれば、理想的な薬の運び屋にすることが可能です。
あるいは、ニューロン内外に持続的に留まり薬を生産し続ける性質に着目すれば、トキソプラズマは薬の運び屋というよりも、配達可能な製薬工場と解釈できるかもしれません。
どちらにしても、特定のタンパク質の不足が原因で起こる脳の病気を解決するためには、これほど有用な方法は他に存在しないでしょう。
理論が完成すると、研究者たちはさっそく実証実験に移りました。
研究ではまずトキソプラズマの遺伝子を改変し、トキソプラズマがもともと分泌しているタンパク質と治療用のタンパク質が結合するように操作しました。
もともとのタンパク質の設計図のすぐ近くに治療用タンパク質の設計図を組み込み、もともとのタンパク質が作られるタイミングで治療用タンパク質も同時に作られ、結合して一緒に分泌されるようにしたのです。
実験ではこの遺伝子操作されたトキソプラズマを、人間やマウスの神経細胞、人工培養脳(脳オルガノイド)、さらに生きているマウスの腹腔に投与しました(腹腔に投与されたトキソプラズマは血液脳関門を突破してマウスの脳に辿り着きます)。
結果、研究者たちの計画通り、GDNF、PARK2、TFEB、SMN1、MeCP2などの治療用タンパク質をニューロン内部に分泌させることに成功しました。
たとえば、レット症候群では患者の細胞が正常なMeCP2を作れないことが原因です。
しかし実験では、トキソプラズマによって正常なMeCP2がマウス脳内に分泌できることが実証されました。
もし同様の仕組みが人間でもうまく機能するならば、既存のウイルスを使った遺伝子治療がうまくいかなかった病気も治せるようになるでしょう。
また、幸いなことに研究に使われたマウスたちは、トキソプラズマの感染に対して目立った悪影響が出ていないことも確認されました。
実際、世界中の健康な人の4人に1人はトキソプラズマに対する抗体を持っていることが知られており、これは彼らが一度はトキソプラズマに感染したことを示しています。
また、多くの人々は自分がトキソプラズマに感染していることに気付いてすらいません。
これは宿主の健康を害して共倒れするのを防ぐために、トキソプラズマが毒性を弱める進化をしたことに起因します。
「脳に感染する寄生虫」というフレーズから恐ろしいものに思われがちですが、脳に感染する寄生虫のすべてが致死的であるわけではないのです。
ただし、トキソプラズマを完全に無害な存在と言い切ることはできません。
これまでの研究により、トキソプラズマは免疫力が低下している人や赤ちゃんでは重篤な症状を引き起こすことが知られています。
また、運んでもらった薬が体に合わなかったり効果が低かった場合には、単にトキソプラズマに感染したという結果だけが残ってしまいます。
さらに、ニューロンの内部に入り込むという感染スタイルもあって、トキソプラズマを排除することは極めて困難であることも知られています。
そのため、研究者たちはトキソプラズマを薬の運び屋として使うには、トキソプラズマの毒性や増殖性を排除したり、特定の化学物質に反応して死滅する「キルスイッチ」を組み込む必要があると提案しています。
(※現在は主に医学用ではなく、脳にタンパク質を送り届ける実験ツールとしての役割が期待されています)
ですがもし将来的に安全性が確保できれば、ウイルスでは不可能だった大きな薬分子(タンパク質)を持続的かつ直接的にニューロンに分泌し続けることが可能になり、トキソプラズマは人類にとってなくてはならない薬の運び屋となるでしょう。
全ての画像を見る
参考文献
Parasite engineered to deliver therapy proteins to nerve cells
https://phys.org/news/2024-07-parasite-therapy-proteins-nerve-cells.html
元論文
Engineering Toxoplasma gondii secretion systems for intracellular delivery of multiple large therapeutic proteins to neurons
https://doi.org/10.1038/s41564-024-01750-6
ライター
川勝康弘: ナゾロジー副編集長。 大学で研究生活を送ること10年と少し。 小説家としての活動履歴あり。 専門は生物学ですが、量子力学・社会学・医学・薬学なども担当します。 日々の記事作成は可能な限り、一次資料たる論文を元にするよう心がけています。 夢は最新科学をまとめて小学生用に本にすること。
編集者
ナゾロジー 編集部



















