京都大学で行われた研究により、iPS細胞を使って卵子や精子の元となる細胞を作ることに成功しました。
また卵子や精子の前段階の細胞を培養する過程で、元の細胞数の100億倍に増殖させることに成功しました。
iPS細胞はあらゆる細胞に変化できる能力を持っていますが、新たな研究はその能力をヒトの卵子や精子の製造に適応できる可能性を示しており、不妊治療などへの応用が期待されています。
今回はなぜiPS細胞とは何かを解説するとともに、卵子や精子の元が作られた過程についてもできるだけ簡単に紹介していきます。
研究内容の詳細は2024年5月20日に『Nature』にて「ヒト生殖系列におけるエピジェネティックな再プログラミングのin vitro再構成(In vitro reconstitution of epigenetic reprogramming in the human germ line)」とのタイトルで発表されました。
iPS細胞から卵子や精子の元を作る過程をわかりやすく解説
iPS細胞を一言で言えば「どんな種類の細胞にも変化できる特殊な細胞」となります。
人間が未熟な子供のうちは職につかない一方で、大人になると特定の役割をもった職につくように、細胞の世界でも未熟で特定の役割を備えていない細胞と、成熟して神経や筋肉といった特定の役割を持つようになった細胞が存在します。
iPS細胞は役割を持つ前の未熟な細胞であり、適切な刺激を与えることで、あらゆる役割を担う成熟した細胞へと変化させることが可能です。
過去には、このような万能性は受精間もない胚からとれる細胞(ES細胞:胚性幹細胞)のみが持っていると考えられていました。
(※ES細胞を手に入れるには受精した胚を破壊しなければなりません)
しかし2012年にノーベル賞を受賞した山中伸弥教授らが開発した技術により、皮膚細胞をiPS細胞へと変化させる技術が開発され、幹細胞技術の普及が一気に進みました。
また近年の研究では、マウスなどの動物から採取した皮膚細胞をiPS細胞に変化させ、さらにiPS細胞を卵子や精子へと変化させる試みが続けられています。
たとえば2015年に行われた研究ではマウスのiPS細胞からマウスの卵子を作り、精子と体外受精することで赤ちゃんマウスを誕生させることに成功しています。
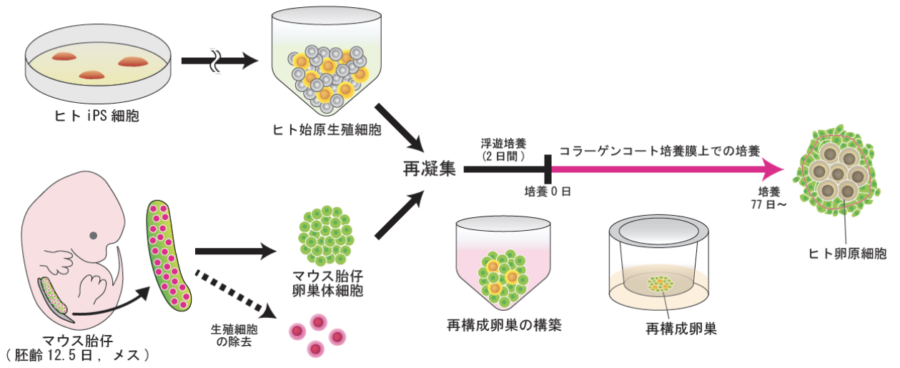
また2018年に発表された研究では、上の図のようにメスマウスの胎仔から取り出した卵巣細胞とヒトiPS細胞を組合わせて培養することで、ヒトの卵子の元となる細胞(卵原細胞)を作ることにも成功しています。
これら技術が完成すれば、最終的には「皮膚細胞を採取➔iPS細胞に変化➔卵子や精子に変化➔受精させて受精卵を作る➔子宮に移植して出産させる」というように皮膚細胞などの体細胞さえあれば、そこから新たな命を作ることが可能となります。
このように元となる細胞(皮膚細胞など)からiPS細胞を経て目的の細胞(卵子や精子)を作ることは「細胞のリプログラム」であると解釈されています。
しかしこの過程を完遂させるには、1つ重大な壁がありました。
私たちの皮膚細胞など体の細胞は、かつて万能性を持っていた受精卵が繰り返し変化して、特定の役割を持つ専門の細胞群へと変化したものです。
そして私たちの体には、この細胞の専門化が逆転しないようにする仕組みが存在します。
逆転を阻止する仕組みがなければ、皮膚細胞が勝手に万能性を獲得して別の神経細胞になるような混乱が起こり、体を正常に維持することができません。
この仕組みは主にDNAの特定のポイントに逆転を阻止するような化合物のタグ付け(エピジェネティック修飾)をすることで行われます。
またタグ付けは逆転防止以外にも、老化によって起こることも知られており、タグ付けのパターンから細胞の年齢を言い当てることすら可能になっています。
もともと1つの受精卵から作られた私たちの体の細胞は、大人になる過程でタグだらけになってしまっているのです。
もしこのタグを剝がさずにiPS細胞から卵子や精子を作ろうとしても上手くいってくれません。
マウスなどを用いた動物実験では、タグを剥がす方法がいくつか発見されていますが、同じ方法をヒトのiPS細胞に使っても完全には上手くいきませんでした。
そこで今回、京都大学の研究者たちは、この壁を乗り越える方法を開発することにしました。
研究ではまずiPS細胞から卵子や精子の元の元と言える始原生殖細胞に似た細胞を作りました。
そしてこの始原生殖細胞に対して、細胞の専門化を促す働きをする「BMP2」というタンパク質を加えてみました。
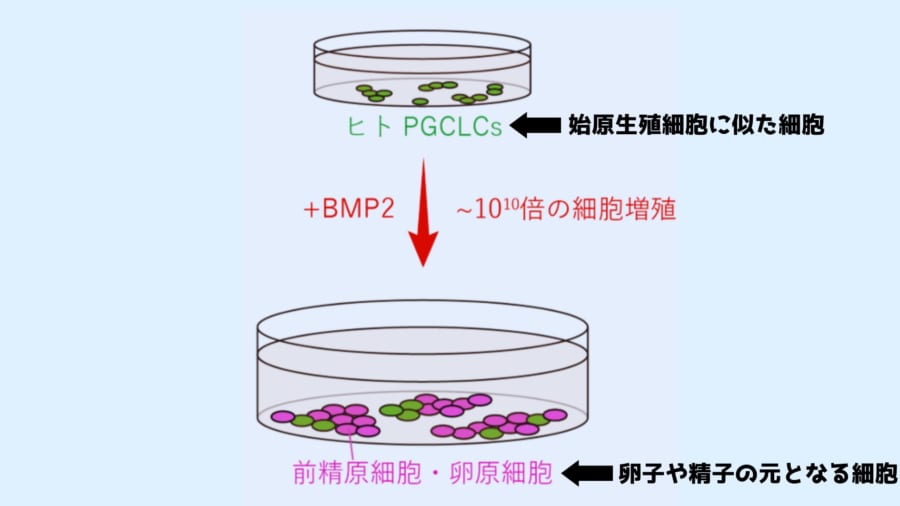
すると始原生殖細胞に似た細胞が、卵子や精子の前段階となる細胞(卵原細胞および前精原細胞)へと変化しました。
そしてこの変化には、積み重なった細胞のタグ付けを解除する効果があったのです。
また一連の培養過程を経て細胞数を100億倍まで増加させることに成功しました。
iPS細胞を使った技術において、細胞数を増加させることは非常に重要です。
実験の現場においては実験サンプルの増加につながるからです。
また卵子や精子の元となる細胞数の増加は、将来的に製造されるかもしれない卵子や精子数を増やすことにつながり、不妊治療の成功を後押ししてくれます。
ただ研究者たちは、現段階においてはタグ付けの解除が完璧ではないと述べています。
BMP2を使ったタグ外しは細胞のリプログラムの穴を突く裏技的な方法だからです。
またもし1つでもタグ付けの解除が失敗していれば複数の遺伝子の働きに影響が及び、正常な受精卵の成長に障害が出る可能性があります。
今回の研究はiPS細胞を用いて卵子や精子の元となる細胞の大量生産に成功したという点において非常に画期的です。
ただ不妊治療など医療に適応するには、技術のブラッシュアップや安全性の確保が必須になるでしょう。
また倫理の点においてヒトiPS細胞を使って作られた卵子や精子を受精させ命へと変化させることに問題を感じる人もいます。
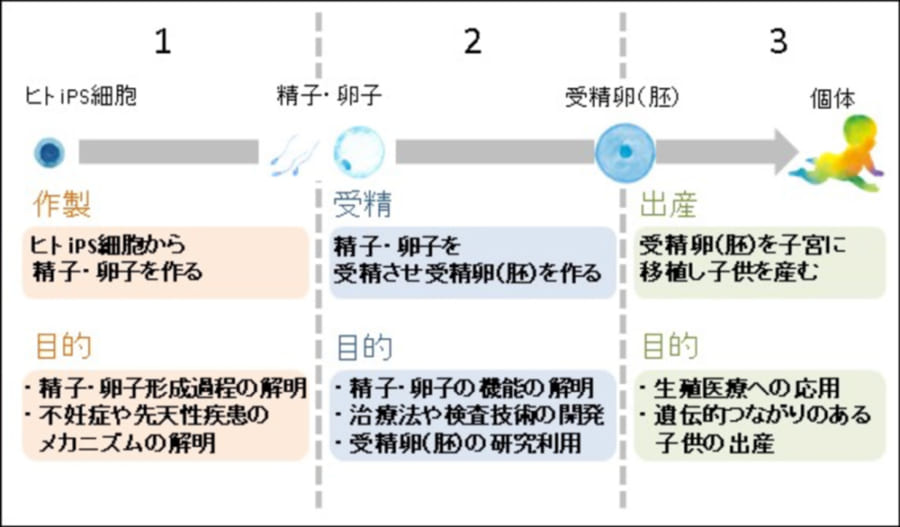
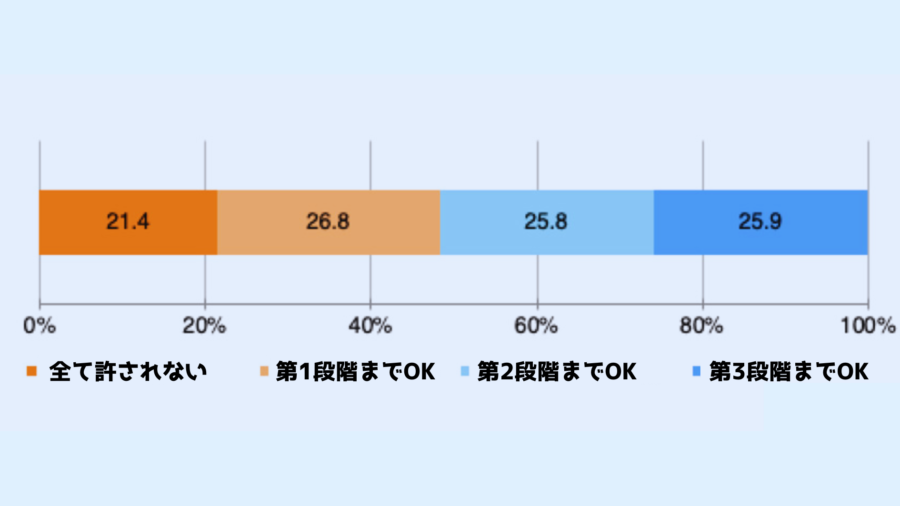
過去に京都大学で行われた研究では、iPS細胞から卵子や精子を作る第1段階、それら卵子や精子を受精させる第2段階、そして受精卵から実際に赤ちゃんを産む第3段階とし、一般市民たちが、どの段階まで許されと考えているのかが調べられました。
結果、全体の4分の1にあたる人々が、出産まで許されると回答しています。
現在の日本では、iPS細胞から卵子や精子を作るまでは認められていますが、作製された卵子と精子を受精させることや、それらを体内(支給など)に戻すことは禁じられています。
ですが、今後の技術発展により人々の意識が変れば、ガイドラインの変更が行われることもあるでしょう。
参考文献
ヒト iPS 細胞から前精原細胞及び卵原細胞を⼤量誘導 ― ヒト⽣殖細胞試験管内造成研究のマイルストーン ―
元論文
In vitro reconstitution of epigenetic reprogramming in the human germ line
ライター
川勝康弘: ナゾロジー副編集長。 大学で研究生活を送ること10年と少し。 小説家としての活動履歴あり。 専門は生物学ですが、量子力学・社会学・医学・薬学なども担当します。 日々の記事作成は可能な限り、一次資料たる論文を元にするよう心がけています。 夢は最新科学をまとめて小学生用に本にすること。
編集者
ナゾロジー 編集部













































